LEYES DE LOS GASES
INTRODUCCIÓN
Un gas es un estado homogéneo de agregación de la materia en que esta tiene la forma y el volumen del recipiente que la contiene. Todos los gases, idealmente se comportan en forma similar ante los cambios de presión y temperatura, pudiéndose expansionar y comprimir entre limites muy amplios, cosa imposibles en liquido y solido.
Los gases, aunque lentamente, tienden a interpretarse entre si , lo que los hacen miscibles en todas proporciones, por esto las mezclas gaseosas son totalmente homogéneas. Para describir y caracterizar un gas es indispensable especificar la temperatura y presión a que se mide su volumen.
A modo de recordatorio.
A modo de recordatorio.
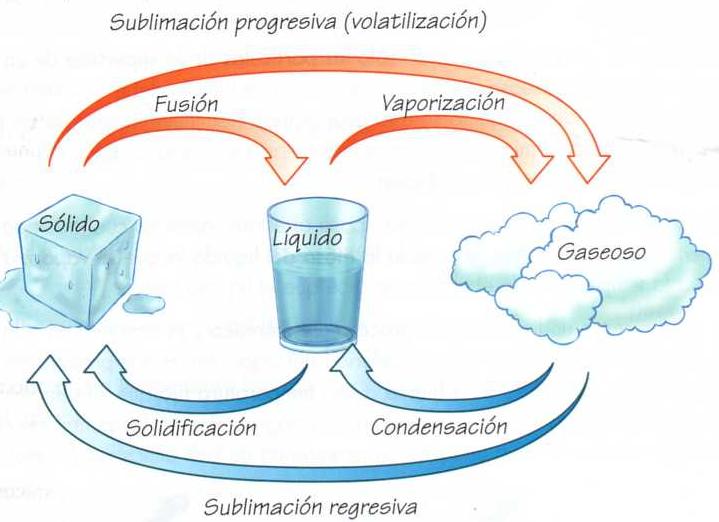
¿Cuáles son los estados de la materia ?: sólido, líquido y gaseoso , que dependen de la presión y de la temperatura a la que se encuentran sometidos.
Distintas materias, distintas fuerzas de cohesión molecular.
En el estado sólido la fuerza de cohesión de las moléculas hace que estas estén muy próximas unas de otros con escaso margen de movimiento entre ellas.
En el estado líquido esta fuerza de cohesión molecular es menor lo cual permite mayor libertad de movimiento entre ellas.
En el estado gaseoso la fuerza de cohesión de las moléculas es muy pequeña, prácticamente nula, lo cual permite que estas se muevan libremente y en todas direcciones.
En este capítulo nos dedicaremos a estudiar este comportamiento de los gases para encontrar una explicación al mismo.
Antes de entrar de lleno en el estudio de las leyes que explican el comportamiento de los gases , veamos cómo influyen en este los eventos físicos que los alteran y que son: temperatura, presión y volumen , además de la cantidad de que se trate.
La determinación de una ecuación de estado de los gases implica inevitablemente la medición de la presión, o fuerza por unidad de área, que un gas ejerce sobre las paredes del recipiente que lo contiene. La presión de los gases comúnmente se expresa en atmósferas o milímetros de mercurio.
El estudio sistemático del comportamiento de los gases le interesó a los científicos durantes siglos. Destacan los nombres de varios investigadores que establecieron las propiedades de los gases. .
Distintas materias, distintas fuerzas de cohesión molecular.
En el estado sólido la fuerza de cohesión de las moléculas hace que estas estén muy próximas unas de otros con escaso margen de movimiento entre ellas.
En el estado líquido esta fuerza de cohesión molecular es menor lo cual permite mayor libertad de movimiento entre ellas.
En el estado gaseoso la fuerza de cohesión de las moléculas es muy pequeña, prácticamente nula, lo cual permite que estas se muevan libremente y en todas direcciones.
En este capítulo nos dedicaremos a estudiar este comportamiento de los gases para encontrar una explicación al mismo.
Antes de entrar de lleno en el estudio de las leyes que explican el comportamiento de los gases , veamos cómo influyen en este los eventos físicos que los alteran y que son: temperatura, presión y volumen , además de la cantidad de que se trate.
La determinación de una ecuación de estado de los gases implica inevitablemente la medición de la presión, o fuerza por unidad de área, que un gas ejerce sobre las paredes del recipiente que lo contiene. La presión de los gases comúnmente se expresa en atmósferas o milímetros de mercurio.
El estudio sistemático del comportamiento de los gases le interesó a los científicos durantes siglos. Destacan los nombres de varios investigadores que establecieron las propiedades de los gases. .
OBJETIVOS
1. Explicar las propiedades de los gases ideales y las leyes que rigen su comportamiento.
2.Deducir la ley combinada de los gases
3.Explicar la idea del mol.
4. Aprender nuevos conceptos de química
5. Aprender a desarrollar diferentes ejercicios de leyes de los gases
MARCO TEÓRICO
Gases

Los gases son el estado de agregación de la materia, en el cual, bajo ciertas condiciones de temperatura y presión sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética Los gases son fluidos altamente comprensibles, que experimentan grandes cambios de densidad con la presión y la temperatura.
Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
A temperatura y presión los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos , estado gaseoso o fase gaseosa.
Características de los gases
1. Los gases no tienen ni forma no volumen propios.
2. son fácilmente comprensibles
3. Forman con otros gases mezclas homogéneas.
4 Ocupan una fracción mínima del volumen del recipiente que los contiene.
¿Qué propiedades tienen los gases?
En los gases, las fuerzas de atracción son casi inexistentes, por lo que las partículas están muy separadas unas de otras y se mueven rápidamente y en cualquier dirección, trasladándose incluso a largas distancias.
Esto hace que los gases tengan las siguientes propiedades:
1.1- No tienen forma propia: No tienen forma propia, pues se adaptan al recipiente que los contiene.
1.2- Se dilatan y contraen: como los sólidos y líquidos.
1.3- Fluidez :Es la propiedad que tiene un gas para ocupar todo el espacio debido a que, prácticamente, no posee fuerzas de unión entre las moléculas que lo conforman.Por ejemplo Cuando hay un gas encerrado en un recipiente, como un globo, basta una pequeña abertura para que el gas pueda salir.

1.4- Difusión :Es el proceso por el cual un gas se mezcla con otro debido únicamente al movimiento de sus moléculas.
Por ejemplo: un escape de gas desde un balón, este tiende a ocupar todo el espacio donde se encuentra mezclándose con el aire.
1.5- Compresión:La compresión es la disminución del volumen de un gas porque sus moléculas se acercan entre si, debido a la presión aplicada.
Por ejemplo: Se puede observar cuando presionas el émbolo de una jeringa mientras tienes tapada su salida.

1.6- Resistencia
Es la propiedad de los gases de oponerse al movimiento de los cuerpos por el aire. Esto se debe a una fuerza llamada fuerza roce. A mayor tamaño y velocidad del cuerpo mayor es la resistencia.
Por ejemplo: un paracaídas o al elevar un volatín, el roce con el aire impide que el volatín caiga al suelo.

Todo acerca de gases,su concepto,propiedades y demás
- Se denomina gas al estado de agregación a la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética. Los gases son fluidos altamente compresible, que experimentan grandes cambios de densidad con la presión y la temperatura.

- Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
otros datos importantes acerca de los gases :
-
A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa
PANTALLAZOS DE CONCEPTOS IMPORTANTES


temperatura:



formulas para convertir la temperatura
presión:
 :
:
La presión (símbolo p) es una magnitud física que mide la proyección de la fuerza en dirección perpendicular por unidad de superficie , y sirve para caracterizar cómo se aplica una determinada fuerza resultante sobre una línea.La presión de cierto vapor o gas puede provocar la ruptura de algún reactor, asi como también en algún instrumento de medición puede arrojar datos relevantes de cualquier estudio. La presión es básicamente usada para determinar procesos en los que la temperatura juega un papel fundamental en la realización de algún experimento con una reacción química.
La presión de un gas se observa mediante la medición de la presión externa que debe ser aplicada a fin de mantener un gas sin expansión ni contracción.
formula:
volumen:

Es la cantidad de espacio que ocupa un cuerpo.
El volumen es una magnitud física derivada. La unidad para medir volúmenes en el Sistema Internacional es el metro cúbico (m3) que corresponde al espacio que hay en el interior de un cubo de 1 m de lado. Sin embargo, se utilizan más sus submúltiplos, el decímetro cúbico (dm3) y el centímetro cúbico (cm3). Sus equivalencias con el metro cúbico son:
1 m3 = 1 000 dm3
1 m3 = 1 000 000 cm3
En química general el dispositivo de uso más frecuente para medir volúmenes es la probeta. Cuando se necesita más exactitud se usan pipetas o buretas.
Las probetas son recipientes de vidrio graduados que sirven para medir el volumen de líquidos(leyendo la división correspondiente al nivel alcanzado por el líquido) y sólidos (midiendo el volumen del líquido desplazado por el sólido, es decir la diferencia entre el nivel alcanzado por el líquido solo y con el sólido sumergido)
cantidad de gas:


ley de los gases:
avogadro:


ley de boyle:


ley de charles:


ley de gay-lussac:


Gases ideales:
La ley de los gases ideales es la ecuación de estado y el gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
donde k es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante k para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
- ecuación:

ley generalizada:

La ley combinada de los gases o ley general de los gases es una ley de los gaes que combina la ley de Bolyle, la ley de Charles y la ley de Gay-Iussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presion y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
puede formularse como:
donde:
- P es la presion
- V es el volumen
- T es la temperatura absoluta
- K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado.
Otra forma de expresarlo es la siguiente:
1. Explicar las propiedades de los gases ideales y las leyes que rigen su comportamiento.
2.Deducir la ley combinada de los gases
3.Explicar la idea del mol.
4. Aprender nuevos conceptos de química
5. Aprender a desarrollar diferentes ejercicios de leyes de los gases
MARCO TEÓRICO
Gases

Los gases son el estado de agregación de la materia, en el cual, bajo ciertas condiciones de temperatura y presión sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética Los gases son fluidos altamente comprensibles, que experimentan grandes cambios de densidad con la presión y la temperatura.
Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
A temperatura y presión los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos , estado gaseoso o fase gaseosa.
Características de los gases
1. Los gases no tienen ni forma no volumen propios.
2. son fácilmente comprensibles
3. Forman con otros gases mezclas homogéneas.
4 Ocupan una fracción mínima del volumen del recipiente que los contiene.
¿Qué propiedades tienen los gases?
En los gases, las fuerzas de atracción son casi inexistentes, por lo que las partículas están muy separadas unas de otras y se mueven rápidamente y en cualquier dirección, trasladándose incluso a largas distancias.
Esto hace que los gases tengan las siguientes propiedades:
1.1- No tienen forma propia: No tienen forma propia, pues se adaptan al recipiente que los contiene.
1.2- Se dilatan y contraen: como los sólidos y líquidos.
1.3- Fluidez :Es la propiedad que tiene un gas para ocupar todo el espacio debido a que, prácticamente, no posee fuerzas de unión entre las moléculas que lo conforman.Por ejemplo Cuando hay un gas encerrado en un recipiente, como un globo, basta una pequeña abertura para que el gas pueda salir.


1.4- Difusión :Es el proceso por el cual un gas se mezcla con otro debido únicamente al movimiento de sus moléculas.
Por ejemplo: un escape de gas desde un balón, este tiende a ocupar todo el espacio donde se encuentra mezclándose con el aire.
1.5- Compresión:La compresión es la disminución del volumen de un gas porque sus moléculas se acercan entre si, debido a la presión aplicada.
Por ejemplo: Se puede observar cuando presionas el émbolo de una jeringa mientras tienes tapada su salida.


1.6- Resistencia
Es la propiedad de los gases de oponerse al movimiento de los cuerpos por el aire. Esto se debe a una fuerza llamada fuerza roce. A mayor tamaño y velocidad del cuerpo mayor es la resistencia.
Por ejemplo: un paracaídas o al elevar un volatín, el roce con el aire impide que el volatín caiga al suelo.
Todo acerca de gases,su concepto,propiedades y demás
- Se denomina gas al estado de agregación a la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética. Los gases son fluidos altamente compresible, que experimentan grandes cambios de densidad con la presión y la temperatura.

- Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
otros datos importantes acerca de los gases :
- A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa
PANTALLAZOS DE CONCEPTOS IMPORTANTES



temperatura:



formulas para convertir la temperatura
presión:
 :
:
La presión (símbolo p) es una magnitud física que mide la proyección de la fuerza en dirección perpendicular por unidad de superficie , y sirve para caracterizar cómo se aplica una determinada fuerza resultante sobre una línea.La presión de cierto vapor o gas puede provocar la ruptura de algún reactor, asi como también en algún instrumento de medición puede arrojar datos relevantes de cualquier estudio. La presión es básicamente usada para determinar procesos en los que la temperatura juega un papel fundamental en la realización de algún experimento con una reacción química.
La presión de un gas se observa mediante la medición de la presión externa que debe ser aplicada a fin de mantener un gas sin expansión ni contracción.
formula:
volumen:

Es la cantidad de espacio que ocupa un cuerpo. El volumen es una magnitud física derivada. La unidad para medir volúmenes en el Sistema Internacional es el metro cúbico (m3) que corresponde al espacio que hay en el interior de un cubo de 1 m de lado. Sin embargo, se utilizan más sus submúltiplos, el decímetro cúbico (dm3) y el centímetro cúbico (cm3). Sus equivalencias con el metro cúbico son: 1 m3 = 1 000 000 cm3 En química general el dispositivo de uso más frecuente para medir volúmenes es la probeta. Cuando se necesita más exactitud se usan pipetas o buretas. Las probetas son recipientes de vidrio graduados que sirven para medir el volumen de líquidos(leyendo la división correspondiente al nivel alcanzado por el líquido) y sólidos (midiendo el volumen del líquido desplazado por el sólido, es decir la diferencia entre el nivel alcanzado por el líquido solo y con el sólido sumergido) cantidad de gas: |


ley de los gases:
avogadro:


ley de boyle:


ley de charles:


ley de gay-lussac:


Gases ideales:
La ley de los gases ideales es la ecuación de estado y el gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
donde k es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante k para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
- ecuación:
ley generalizada:

La ley combinada de los gases o ley general de los gases es una ley de los gaes que combina la ley de Bolyle, la ley de Charles y la ley de Gay-Iussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presion y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
puede formularse como:
donde:
- P es la presion
- V es el volumen
- T es la temperatura absoluta
- K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado.
Otra forma de expresarlo es la siguiente:





















































No hay comentarios:
Publicar un comentario